Ein lustiger Gedanke: Du wirst älter. Ja, deine Zellen ticken weiter und zeigen den Lauf der Zeit an, auch wenn du in der Blüte deiner Jugend stehst. Und wenn wir ehrlich sind, kann die Art und Weise, wie du in den letzten Jahren gelebt hast, eine Beschleunigung deines Alterungsprozesses sein.
Lass uns innehalten, bevor du dich von diesem Gedanken stressen lässt und dann noch schneller alterst. Was wäre, wenn wir die inneren Prozesse des Alterns verstehen und mit diesem Wissen unsere Lebenserwartung erhöhen könnten? Das ist die Zeit, die du damit verbringst, gesund und aktiv zu sein.
Stell dir vor, du würdest deinen 80. Geburtstag mit einem Fallschirmsprung feiern, anstatt mit einem Stock in der Hand? Wichtig ist, dass du verstehst, wie dein Körper altert, zumindest bis zu einem gewissen Grad. In der Wissenschaft wurden 12 Kennzeichen des Alterns identifiziert – 12 Mechanismen, die deinen Körper altern lassen.
Wir werden dich mit diesen Mechanismen vertraut machen, damit du sie zu deinem eigenen Vorteil verändern kannst.
In diesem Artikel
Kostenloser Guide zur Umkehrung deines biologischen Alters

- Lerne die Wissenschaft der Verjüngung kennen.
- Wende bewährte Tipps an, um die biologische Uhr zurückzudrehen.
- Transformiere deine Gesundheit mit den besten Longevity-Expert*innen.
Was ist überhaupt ein Alterskennzeichen?
3 Kriterien definieren ein Alterskennzeichen:
- Seine zeitabhängige Ausprägung
- Das Potenzial für eine experimentelle Beschleunigung der Alterung
- Und vor allem das Potenzial für therapeutische Massnahmen zur Verlangsamung oder Umkehrung des Alterungsprozesses
Diese Kennzeichen bieten uns einen Rahmen, um die Komplexität des Alterns sowohl auf der molekularen als auch auf der zellulären und systemischen Ebene zu erforschen. Für die Entwicklung neuer Massnahmen des Anti-Aging sind sie ebenfalls wegweisend.
In der aktualisierten Liste sind die immer ausgefeilteren Instrumente wie die „Omics“-Technologien berücksichtigt, die uns heute zur Untersuchung des Alterns zur Verfügung stehen, sowie die wachsende Evidenzbasis, die nun auch Säugetiermodelle umfasst.
Die klinische Relevanz wird durch den Rahmen der Kennzeichen des Alterns gewährleistet. Der gewählte Ansatz wird dadurch untermauert, dass Krankheiten, die mit dem gleichen Kennzeichen assoziiert sind, mit grösserer Wahrscheinlichkeit gemeinsam auftreten und gemeinsame genomische Kennzeichen aufweisen [1].
Unser Ziel ist es, die einzelnen Kennzeichen aufzuschlüsseln und ihren Zusammenhang mit dem Altern und altersbedingten Krankheiten zu verstehen.
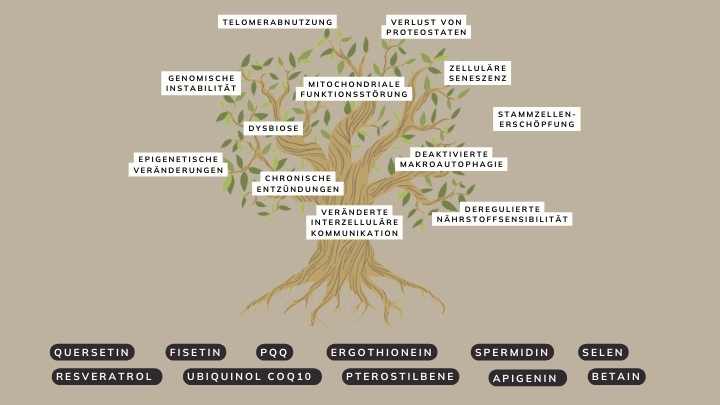
Was sind die 12 Kennzeichen des Alterns?
Seit der bahnbrechenden Veröffentlichung von „Kennzeichen des Alterns“ im Jahr 2013 ist der Bereich der Gerontologie explosionsartig gewachsen. Fast 300.000 Studien – so viele wie im gesamten letzten Jahrhundert – wurden erstellt.

Mit zunehmendem Wissen wurde es notwendig, diese Kennzeichen zu aktualisieren. Ursprünglich waren 9 Hauptkennzeichen Gegenstand der Beschreibung:
- DNA-Instabilität
- Telomerverschleiss
- epigenetische Veränderungen
- Verlust der Proteostase
- Deregulierte Nährstoffsensitivität
- mitochondriale Dysfunktion
- zelluläre Seneszenz
- Stammzellenerschöpfung
- veränderte interzelluläre Kommunikation
Dabei handelt es sich nicht um isolierte Prozesse, sondern sie greifen ineinander und beeinflussen sich gegenseitig. Die Liste der Kennzeichen wurde im Rahmen der Aktualisierung der Kennzeichen um drei weitere ergänzt:
- deaktivierte Makroautophagie
- chronische Entzündung
- Dysbiose
1. Genomische Instabilität
Der Begriff „instabiles Genom“ bezieht sich in erster Linie auf die Tatsache, dass die DNA nicht so stabil ist, wie es wünschenswert wäre. Dazu gehören nicht nur gelegentliche DNA-Brüche, sondern auch Veränderungen, die von Punktmutationen und Deletionen bis zu Chromosomenumlagerungen reichen. Durch Replikationsfehler und oxidative Prozesse ist unsere zelluläre DNA internen und externen Bedrohungen ausgesetzt.
Mit zunehmendem Alter verlieren die DNA-Reparaturmechanismen, die zellulären Wächter, ihre Wirksamkeit. Bei Stammzellen, die für die Erneuerung des Gewebes verantwortlich sind, ist dies besonders problematisch. Akkumulierte DNA-Schäden können zu Gewebedegeneration und erhöhter Krankheitsanfälligkeit führen.
Die Ergebnisse deuten darauf hin, dass Tiere mit einer geringeren Anzahl von DNA-Mutationen in der Regel eine höhere Lebenserwartung haben. Es sind zwar noch weitere Studien erforderlich, aber wir können mit Sicherheit sagen, dass wir auf dem Weg zu längerer Gesundheit und vielleicht sogar Longevity sind, wenn wir einen Weg zur Stabilisierung unserer DNA im Laufe unseres Lebens finden.
Ein Molekül, das wir im Auge behalten sollten, ist das Sirtuin-6 (SIRT6), von dem gezeigt werden konnte, dass es die DNA-Reparatur bei Mäusen verbessert und die Lebensspanne verlängert. Schliesslich müssen wir uns nicht nur um die Zellkern-DNA, sondern auch um die Mitochondrien-DNA kümmern. Auch hier könnte die Verbesserung der Reparaturmechanismen ein Weg zur Verlangsamung des Alterns sein.
2. Verkürzung der Telomere
Eine Region, die Telomere genannt wird, befindet sich am Ende jedes Chromosoms. Diese Telomere sind so etwas wie die Schnüre eines Schnürsenkels – sie verhindern, dass die DNA ausfranst und sich auflöst.
Wenn sich Zellen jedoch teilen, verkürzen sich diese Telomere, was zu einer genomischen Instabilität führt und die Zellen entweder in die Selbstzerstörung (Apoptose) oder in einen Zustand, in dem sie sich nicht mehr teilen (Seneszenz), treibt. Wie man sich vorstellen kann, ist beides nicht gut für die Longevity. Alter, Genetik, Lebensstil und sogar soziale Faktoren beeinflussen die Telomere.
Doch die Natur hat einen Retter gefunden: die Telomerase. Dabei handelt es sich um ein Enzym, das die Telomere verlängern und so die schädlichen Auswirkungen aufhalten kann.
Das Problem ist, dass die meisten unserer Zellen nicht genug davon produzieren, was zur Folge hat, dass sich die Telomere im Laufe der Zeit immer mehr verkürzen. Es ist also so, als hätten wir ein Reparaturwerkzeug, aber es ist in den Schuppen eingeschlossen.
Der Verschleiss der Telomere hat einen Silberstreif am Horizont, denn er kann die Lebensdauer bösartiger Zellen begrenzen und so die Entstehung von Krebs erschweren. Im Gegensatz zur genomischen Instabilität, die einfach nur schlecht ist, hat die Abnutzung der Telomere also eine Doppelfunktion, und die Wissenschaftler/innen hoffen auf die Nutzung ihrer Vorteile.
Forschungen haben gezeigt, dass die Telomerlänge die Lebenserwartung verschiedener Spezies vorhersagen kann. Es gibt auch Proteine, so genannte Shelterine, die für die Erhaltung der Integrität der Telomere verantwortlich sind. Ein Mangel dieser Proteine kann unabhängig von der Telomerlänge vorzeitiges Altern verursachen.
Nun zum spannenden Teil: Interventionen. Studien an Mäusen haben gezeigt, dass die Aktivierung der Telomerase zu einer Verlängerung der Lebensspanne und zu einer Verbesserung der Gesundheit führen kann. Es ist, als gäbe man Zellen, die es brauchen, ein Werkzeug in die Hand, das weggeschlossen ist.
Beim Menschen werden kurze Telomere mit Krankheiten wie Lungen- und Nierenfibrose in Verbindung gebracht, so dass die Aktivierung der Telomerase möglicherweise dazu beitragen könnte, das Auftreten dieser altersbedingten Krankheiten zu verzögern.
3. Epigenetische Veränderungen
Das Genom ist ein komplexer Bauplan des Lebens. Epigenetische Veränderungen sind wie Anmerkungen und Markierungen auf diesem Bauplan.
Diese winzigen, oft rückgängig zu machenden Veränderungen können weitreichende Folgen für die Art und Weise haben, wie Gene von Zellen abgelesen oder exprimiert werden. Mit zunehmendem Alter geraten die Notizen durcheinander, was dazu führt, dass die Zellen chaotisch und weniger effizient arbeiten.
Erfahre, wie die Epigenetik deine Gesundheit beeinflusst.
Eine der wichtigsten epigenetischen Veränderungen, die beobachtet wird, wenn wir altern, ist die DNA-Methylierung – das Hinzufügen von Methylgruppen zu DNA-Molekülen.
Man kann sich die DNA-Methylierung als Dämmerungsschalter des genomischen Haushalts vorstellen. Zu viel oder zu wenig Licht kann Probleme verursachen.
Im Laufe des Alterns werden einige Bereiche des Genoms hypermethyliert, was zum Abschalten wichtiger Gene führen kann. Auf der anderen Seite werden einige Bereiche des Genoms hypomethyliert, was zur Folge hat, dass Gene aktiviert werden, die eigentlich inaktiv sein sollten. Das Ergebnis ist eine Störung des Gleichgewichts und ein erhöhtes Risiko für Krankheiten wie Krebs und einen allgemeinen Zustand des Zellverfalls.
Ein weiterer wichtiger Akteur sind die Histone. Histone sind Proteine, die für die Verpackung der DNA zuständig sind. Im Laufe der Zeit kann es jedoch durch Veränderungen der Histone (Acetylierung und Methylierung von Histonen) zu einer Lockerung oder Straffung des Genoms kommen.
Dies kann zu einer fehlerhaften Expression von Genen führen. Einige Proteine, wie z. B. die Sirtuine, versuchen, das Gleichgewicht wiederherzustellen, aber auch ihre Wirksamkeit kann mit zunehmendem Alter nachlassen, so dass das Gleichgewicht noch weiter in Richtung Chaos verschoben wird.
Dann gibt es noch die nicht-kodierenden RNAs (RNAs), die oft übersehen werden, von denen aber immer mehr erkannt wird, dass sie eine wichtige Rolle bei der Alterung spielen. Diese RNA-Moleküle können entweder eine Hemmung oder eine Verstärkung der Expression bestimmter Gene bewirken. Mit zunehmendem Alter können sich Menge und Art der nicht-kodierenden RNAs verändern. Dies trägt zu altersbedingten Krankheiten und zum Zellabbau bei.
Das Ergebnis all dieser epigenetischen Elemente sind Veränderungen in der Genexpression, die sich als Alterung manifestieren. Dieser Prozess wird mit der Zeit zunehmend chaotisch und beeinträchtigt wichtige biologische Prozesse wie Entzündungsreaktionen und die mitochondriale Funktion.

Dass viele epigenetische Veränderungen wieder rückgängig gemacht werden können, ist besonders spannend.
Damit eröffnet sich die Möglichkeit, gezielt in die epigenetischen Veränderungen einzugreifen, um bestimmte Aspekte des Alterns zu verlangsamen oder vielleicht sogar rückgängig zu machen.
This opens up the possibility of therapeutically targeting epigenetic changes to either slow down or perhaps even reverse aspects of ageing.
4. Verlust der Proteostase
Die Proteostase oder Proteinhomöostase ist ein fein abgestimmtes System, das Proteine synthetisiert, faltet und abbaut. Für die Aufrechterhaltung von Struktur und Funktion der Proteine in unserem Körper ist dieser zelluläre Mechanismus von entscheidender Bedeutung.
Mit zunehmendem Alter kann dieses System an Effizienz verlieren, was eine Anhäufung fehlgefalteter oder beschädigter Proteine zur Folge hat. Ein biochemisches Chaos entsteht, das mit altersbedingten Krankheiten wie Alzheimer und Parkinson zusammenhängt.
Fehlgefaltete Proteine können die Zellmaschinerie blockieren und wichtige Zellfunktionen stören. Die gestörte Übersetzung von Proteinen wirkt sich direkt auf die Lebensdauer verschiedener Organismen aus.
Ein weiterer Übeltäter ist der oxidative Stress. Er lenkt die zellulären Chaperone, die bei der Proteinfaltung helfen sollen, zusätzlich ab und verschlimmert so das Problem.
Im Laufe der Zeit wird das System immer ineffizienter, was zu einer weiteren Anhäufung von Proteinen führt, die in der Regel fehlerhaft sind.
Das Problem wird dadurch verschärft, dass die Proteostase stark von Qualitätskontrollmechanismen wie der Unfolded Protein Response (UPR) im endoplasmatischen Retikulum (ER) abhängt.
Eine weitere Ebene der Qualitätskontrolle wird geschwächt, wenn die Wirksamkeit der UPR mit der Zeit abnimmt. In gealterten Geweben wurde auch beobachtet, dass die Aktivität des Proteasoms, der zellulären Müllabfuhr, nachlässt.
Die Chaperon-vermittelte Autophagie (CMA) spielt eine Rolle beim selektiven Abbau von Proteinen. Kurz gesagt ist es ein System zum Abbau und Entfernen von nicht benötigten Proteinen, dessen Effizienz jedoch mit der Zeit nachlässt, was zum Altern und zu Krankheiten wie Alzheimer beiträgt.
Als vielversprechend für die Verbesserung von Aspekten des Alterns haben sich Strategien wie die Stimulierung der Autophagie zum Abbau von Proteinaggregaten oder die Verbesserung der CMA erwiesen. Bei Mäusen wurde eine Verbesserung der Proteostase und der Lebenserwartung festgestellt.
Lerne, wie du die Autophagie mit 4 einfachen, wissenschaftlich untermauerten Schritten fördern kannst.
5. Deaktivierte Makrophagie
Ist die Autophagie ausgeschaltet oder beeinträchtigt, ist das wie ein defektes Müllabfuhrsystem. Dysfunktionale Zellmaschinen sammeln sich an, von Proteinaggregaten bis hin zu abgenutzten Mitochondrien.
Diese Vermüllung des Zellmilieus hat Auswirkungen auf alles, von der Fähigkeit der Zelle zur Energiegewinnung über die Mitochondrien bis hin zur effektiven Beseitigung von Krankheitserregern. Mit zunehmendem Alter nimmt die Autophagie-Aktivität ab.
Eine Störung der Autophagie hat Entzündungsschübe, eine Verschlechterung der Zellfunktion und eine erhöhte Anfälligkeit für Krankheiten zur Folge. Es ist klar, dass das Fehlen einer gut funktionierenden Autophagie ein wichtiges Thema im Zusammenhang mit dem Altern und der Longevity ist.
Es wird sogar vermutet, dass eine mangelnde Autophagie mit einem erhöhten Krebsrisiko einhergeht. Die Autophagie hält also nicht nur die Zelle gesund, sondern überwacht und steuert auch potentiell maligne Aktivitäten.
Die Stimulierung der Autophagie hat sich in Tiermodellen als vielversprechend erwiesen.

Eine Supplementation mit Spermidin erhöht die Lebenserwartung von Mäusen um 25 % und verringert die Alterung des Herzens.
Entdecke 8 Vorteile von Spermidin, die du kennen solltest.
NAD+-Vorstufen (Nicotinamid, Nicotinamid-Mononukleotid, Nicotinamid-Ribosid) und Urolithin A haben ähnliche positive Wirkungen gezeigt, was den Weg für weitere therapeutische Interventionen ebnet.
Was ist NAD+ und warum ist es wichtig?
Die Tatsache, dass diese Interventionen den Alterungsprozess nicht nur verlangsamen, sondern aktiv umkehren können, ist für den Bereich der Longevity besonders bemerkenswert.
6. Deregulierte Nährstoffsensitivität
Aufgrund ihrer Rolle bei der Regulation des Stoffwechsels und der Alterung faszinieren Nährstoffsensoren die Wissenschaft seit Jahren.

Weisst du, dass es Mechanismen gibt, die sowohl auf Nährstoffe als auch auf Stressfaktoren reagieren, um die Zellaktivität zu regulieren? Dazu gehören die Autophagie und der Stoffwechsel.
Diese Stoffwechselwege umfassen Hunderte von Molekülen, die ein Netzwerk bilden, das für die Aufrechterhaltung der Zellfunktionen, insbesondere im Alter, von entscheidender Bedeutung ist.
In jungen Jahren fördert das Netzwerk der Nährstoffsensoren anabole Prozesse. Das sind Prozesse, die Zellbestandteile aufbauen. Mit zunehmendem Alter kehrt sich das um.
Die gleichen Mechanismen, die uns früher geholfen haben zu wachsen und uns zu reparieren, haben jetzt altersfördernde Eigenschaften. Diese Veränderung wirft die Frage auf: Ist es möglich, dieses Netzwerk so umzuprogrammieren, dass es zu unseren Gunsten arbeitet, wenn wir älter werden?
Dass eine verminderte Aktivität bestimmter Moleküle die Lebensspanne tatsächlich verlängern kann, haben genetische Studien an Tiermodellen gezeigt. Beim Menschen wurden ähnliche Ergebnisse beobachtet.
Sowohl Supplements wie NAD+ als auch diätetische Massnahmen wie Fasten können diese vorteilhaften genetischen „Defekte“ nachahmen und unsere eigene Lebensspanne verlängern.
Beides hat sich in Tiermodellen als vielversprechend für die Verlängerung der Lebenserwartung erwiesen und deutet auch auf mögliche Vorteile für die Gesundheit des Menschen hin. Weitere Studien zu Ernährungsinterventionen sind erforderlich, da der männliche und der weibliche Körper biologisch unterschiedlich aufgebaut sind.
Die Aussicht, den Nährstoffhaushalt gezielt zu beeinflussen, könnte unseren Ansatz zur Bekämpfung altersbedingter Krankheiten und zur Lebensverlängerung revolutionieren.
7. Mitochondriale Dysfunktion
Als Kraftwerke der Zelle werden die Mitochondrien seit langem gefeiert. Doch ihre Rolle geht weit darüber hinaus: Sie regulieren auch Entzündungen und verhindern, dass Zellen absterben.
Verschiedene Faktoren führen dazu, dass die Funktion der Mitochondrien mit zunehmendem Alter abnimmt. Dazu gehören Mutationen der mitochondrialen DNA (mtDNA), die Destabilisierung der Atmungskettenkomplexe, ein verminderter Umsatz der Organellen und eine veränderte Dynamik der Mitochondrien.
Diese Fehlfunktionen führen dazu, dass Moleküle freigesetzt werden, die verschiedene Signalwege aktivieren.
Diese Signalwege beeinträchtigen nicht nur die zelluläre Energieproduktion, sondern führen auch dazu, dass sich Zellen entzünden und absterben.
Man könnte annehmen, dass die Verbesserung der Funktion der Mitochondrien der einzige Schlüssel zu einem längeren und gesünderen Leben ist, aber ein faszinierendes Phänomen namens „Mitohormesis“ bietet eine andere Sichtweise.
Durch eine milde Hemmung der Mitochondrienaktivität – vor allem in frühen Entwicklungsstadien – wird eine hormonelle Reaktion ausgelöst, die in Modellorganismen wie C. elegans und Drosophila die Lebensspanne verlängern kann.
Bei gebrechlichen und älteren Menschen wurde in klinischen Studien über positive Effekte bestimmter Supplements berichtet.
Aufgrund ihrer Fähigkeit, die Autophagie auszulösen, gewinnen auch die Plasmaspiegel mitochondrialer Mikroproteine an Bedeutung. Die Spiegel dieser Proteine, die mit zunehmendem Alter abnehmen, sind bei Hundertjährigen und ihren Nachkommen ungewöhnlich hoch.
Tier- und Zellmodelle liefern wertvolle Erkenntnisse. Die Übertragung dieser Erkenntnisse auf die Gesundheit und Longevity des Menschen bleibt eine schwierige, aber spannende Herausforderung.
8. Zelluläre Seneszenz
Von zellulärer Seneszenz spricht man, wenn sich unsere Zellen offiziell in den „Ruhestand“ verabschieden und sich nicht mehr teilen – dies wird auch als „Zombie-Zellen“ bezeichnet. Dies ist eine Folge des Alterns und kann bei jeder Art von Zellen der Fall sein. Während man früher davon ausging, dass es sich dabei nur um ein Mittel zur Vorbeugung von Krebs handelt, wird es heute auch als Ursache für das Altern und andere Krankheiten angesehen.
Die zelluläre Seneszenz tritt als Folge von Schäden an der DNA, der Verkürzung der Telomere und anderer Arten von Stress, wie z. B. Infektionen, auf. Ursprünglich ist die Seneszenz eine nützliche Reaktion auf Schäden. Das Immunsystem nimmt sich eine Auszeit, um die Schäden zu beseitigen. Mit zunehmendem Alter oder bei chronischen Krankheiten ist der Aufräumprozess jedoch nicht mehr so effizient.
Diese Zellen können die Ursache für das Altern benachbarter Zellen sein, was wiederum zu einer Anhäufung dieser ungesunden Zellen führt. Dabei werden eine Reihe von Chemikalien produziert, die Entzündungen und Fibrose (Verdickung und Vernarbung des Bindegewebes) verursachen können. Bei Krankheiten wie Diabetes, Alzheimer und vielen anderen spielen sie ebenfalls eine Rolle.
Gesteuert wird die zelluläre Seneszenz durch bestimmte interne Proteine, die die Zelle an der Teilung und an der Veränderung ihres Verhaltens hindern. Obwohl es keinen einheitlichen Test gibt, um seneszente Zellen zu erkennen, kann man auf eine Kombination von Kennzeichen wie bestimmte Proteine, Chemikalien und anderes Zellverhalten achten, um eine begründete Vermutung aufzustellen.Hier kommen die „Senolytika“ ins Spiel. Das sind Medikamente, die selektiv diese alternden Zellen abtöten. Einige von ihnen befinden sich in verschiedenen Stadien der klinischen Erprobung und haben sich als vielversprechend für die Behandlung von Krankheiten erwiesen.
Hier erfährst du mehr über Senolytika.
9. Erschöpfung der Stammzellen
Das Altern geht einher mit einer Abnahme der Gewebeerneuerung im Dauerzustand und einer Beeinträchtigung der Gewebereparatur bei Verletzungen. Jedes Organ hat seine eigene Erneuerungs- und Reparaturstrategie.
Mit zunehmendem Alter ist der Körper weniger in der Lage, sich selbst zu reparieren, und zwar sowohl im Hinblick auf die allgemeine Instandhaltung als auch auf die Heilung von Verletzungen. Jedes Organ hat seine eigene Reparatur- und Erneuerungsstrategie.
- Im Skelettmuskel ist für die tägliche Erneuerung und Reparatur ein einziger Zelltyp, die Satellitenzelle, zuständig.
- In der Haut, die sich durch eine hohe Erneuerungsrate auszeichnet und Verletzungen ausgesetzt ist, gibt es mehrere „Nachbarschaften“ von Stammzellen, insbesondere um die Haarfollikel herum.
- Andere Organe, wie z. B. die Leber, die Lunge oder die Bauchspeicheldrüse, weisen unter normalen Bedingungen eher niedrige Erneuerungsraten auf.
Wenn du verletzt bist, können verschiedene Zelltypen vorübergehend wie Stammzellen handeln, um den Schaden zu reparieren.

Die Fähigkeit der Zellen, sich als Reaktion auf Verletzungen anzupassen und zu verändern, könnte für das Altern relevanter sein als die Flexibilität unserer „normalen“ Stammzellen.
Wie alle Zellen sind auch Stammzellen und ihre „Babyzellen“, die Vorläuferzellen, dem Alterungsprozess unterworfen. Wenn die Anzahl dieser Zellen abnimmt, kann sich dein Körper nicht mehr richtig reparieren, was dazu führt, dass du alterst und anfälliger für Krankheiten wirst.
Bei der zellulären Reprogrammierung werden adulte Zellen mit Hilfe bestimmter „genetischer Schalter“ (Transkriptionsfaktoren) wieder in einen Zustand versetzt, der dem der embryonalen Stammzellen ähnelt.
Die natürliche Gewebereparatur und die künstliche Reprogrammierung haben viele Gemeinsamkeiten. Sie könnten neue Wege zur Verjüngung alternder Gewebe eröffnen.
Die Reprogrammierung kann durch Beeinflussung verschiedener Alterungsmarker wie DNA-Schäden und epigenetische Muster dazu beitragen, die Lebensspanne von Zellen zu verlängern.
In Experimenten mit Mäusen führte die Reprogrammierung dazu, dass sich das Gewebe von älteren Mäusen genauso effizient selbst reparieren konnte wie das Gewebe von jungen Mäusen.
10: Chronische Entzündung
Zweifellos sind Entzündungen das beste Beispiel für ein zweischneidiges Schwert. Entzündungen gehören zum natürlichen Abwehrmechanismus des Körpers, aber ein Zuviel kann problematisch sein, besonders im Alter.
Sprechen wir von „Inflammaging“, einem Begriff zur Beschreibung der chronischen Entzündung auf niedrigem Niveau, die mit dem Altern einhergeht. Im Zusammenhang mit dem Altern ist häufig die Rede von den im Blut zirkulierenden Konzentrationen von Entzündungsmarkern.

Erhöhte Entzündungsmarker sind ein starker Prädiktor für die Gesamtmortalität in alternden Bevölkerungen.
Erhöhte Entzündungswerte führen zu verminderter Immunfunktion und machen den Körper anfälliger für Infektionen, Krebs und Autoimmunerkrankungen. Für die goldenen Jahre ist das zumindest kein gutes Zeichen.
Entzündungen treten nicht isoliert auf. Sie steht in engem Zusammenhang mit anderen Kennzeichen des Alterns, wie z. B. einer genomischen Instabilität, einer gestörten Autophagie und einer gestörten Proteostase.
Genomische Mutationen können beispielsweise zu einer so genannten klonalen Hämatopoese führen. Dabei vermehrt sich eine bestimmte Art von Blutzellen ungewöhnlich stark, was zu Entzündungen führt und die kardiovaskuläre Alterung beschleunigt.
Entzündungshemmende Therapien haben sich in präklinischen Modellen als vielversprechend erwiesen. Dazu gehören verschiedene Manipulationen an unterschiedlichen Organsystemen.
11: Dysbiose
Ein Thema von wachsendem Interesse in der wissenschaftlichen Forschung ist die komplexe Beziehung zwischen der Darmmikrobiota und dem Altern. Auf der einen Seite spielt das Darmmikrobiom eine zentrale Rolle bei physiologischen Prozessen, die von der Nährstoffaufnahme bis hin zur Immunregulation reichen, und hat damit erhebliche Auswirkungen auf die Gesundheit des Wirts.
Auf der anderen Seite werden Störungen in diesem komplexen Ökosystem, die als Dysbiose bezeichnet werden, mit altersbedingten Krankheiten in Verbindung gebracht, die von Herz-Kreislauf-Erkrankungen bis hin zu neurodegenerativen Erkrankungen reichen.
Veränderungen der intestinalen Mikrobiota sind durch eine generelle Abnahme der mikrobiellen Diversität gekennzeichnet und weisen unterschiedliche Muster auf, wie bestimmte Bakteriengattungen vorkommen.

Studien zur fäkalen Mikrobiota-Transplantation (FMT) zeigen die ursächliche Rolle der Darmdysbiose bei altersbedingten systemischen Entzündungen und der Abnahme der adaptiven Immunität.
Dass die Darmmikrobiota manipuliert werden kann, um das alternde Immunsystem und das Gehirn zu verjüngen, haben mehrere Studien gezeigt.
Bestimmte Probiotika und Metaboliten haben sich als vielversprechend für die Wiederherstellung eines jugendlichen Mikrobioms erwiesen, was zu einer besseren Gesundheit und möglicherweise zu einer Verlängerung der Lebensdauer führen kann.
Durch diese wissenschaftlichen Erkenntnisse über das Darmmikrobiom und das Altern wird der Weg für gezielte Interventionen geebnet, die möglicherweise prä-, pro- und postbiotische Massnahmen umfassen, um die Gesundheit älterer Menschen zu verbessern.
In Anbetracht der Heterogenität des Darmmikrobioms, das durch Faktoren wie Ernährung, Genetik und Umwelt beeinflusst wird, ist es von entscheidender Bedeutung, personalisierte Ansätze zu verwenden, um eine maximale Wirksamkeit zu erzielen.
12: Veränderte interzelluläre Kommunikation
Mit zunehmendem Alter verändert sich die Art und Weise der Kommunikation zwischen den Zellen erheblich, was zu einer Art „statischem Rauschen“ im biologischen System und damit zu einer Beeinträchtigung seiner optimalen Funktion führt.
Normalerweise verfügt unser Körper über hormonelle, neuronale und neuroendokrine Systeme, die für Stabilität sorgen – zum Beispiel Insulin, um den Blutzuckerspiegel zu regulieren, oder Adrenalin, um schnell Energie zur Verfügung zu stellen.
Diese Kommunikationssysteme versagen mit zunehmendem Alter. Dies betrifft nicht nur die Abnahme der Sexualhormone, die oft mit dem reproduktiven Altern assoziiert wird, sondern Störungen betreffen verschiedene Systeme wie Insulin/IGF1 und sogar Neurotransmitter wie Dopamin.
Diese Kommunikationsstörungen sind häufig zellintern, d. h. in den Zellen selbst begründet. Sie tragen zu weitergehenden systemischen Problemen bei, wie z.B. chronische Entzündungen, geschwächte Immunität gegen Pathogene und irreguläres Zellwachstum.
Durch eine gestörte interzelluläre Kommunikation wird auch der gesunde Dialog zwischen unserem menschlichen Genom und unserem Mikrobiom gestört, was zu einem Ungleichgewicht im Darm, einer „Dysbiose“, führt.

Die veränderte zellulare Kommunikation umfasst sowohl Langstrecken- als auch Kurzstreckenkommunikationssysteme.
Beispielsweise spielt das Gehirn bei der Alterung peripherer Organe eine wichtige Rolle.
Bestimmte Gene im Gehirn zu manipulieren, kann tatsächlich die Longevity von Mäusen erhöhen, obwohl die genauen Mechanismen, die diesen weitreichenden Effekten zugrunde liegen, noch nicht vollständig verstanden sind.
Die Kommunikation über kurze Distanzen ist nicht weniger komplex und umfasst eine Vielzahl von Molekülen, die von Geweben wie weissem und braunem Fett, Herz, Leber und Muskeln freigesetzt werden.
Diese sezernierten Faktoren interagieren mit anderen Zellen über verschiedene Liganden und Rezeptoren oder sogar über direkte Zell-Zell-Verbindungen, und auch diese Interaktionen werden mit zunehmendem Alter verändert.
Mit der Zeit verliert auch unsere extrazelluläre Matrix (ECM), das „Gerüst“ unserer Gewebe, an Funktion. Im Alter verändern sich ihre strukturellen Bestandteile erheblich, was zu Gewebefibrose oder „Fibroaging“ führt.
Mit zunehmendem Alter wird diese ECM nicht nur starrer, sondern auch seneszente Zellen werden in ihrer Funktion beeinträchtigt, was in einem Teufelskreis zu einer weiteren Schädigung der ECM führt. Durch diese Versteifung können weitere pro-fibrotische Prozesse in Gang gesetzt werden, wodurch der Alterungsprozess noch komplexer wird.
Bei älteren Mäusen konnte gezeigt werden, dass sich bestimmte Zellen im Gehirn durch die Hemmung bestimmter Faktoren verjüngen. Eine entscheidende Rolle spielt auch das Protein Kollagen, das einen großen Teil des Körpers strukturiert.
Erfahre hier mehr über die Rolle von Kollagen Supplements.
Lösungen von Avea: Die Kennzeichen des alternden Baumes
Das Avea Reset Bundle wurde entwickelt, um mehrere Zeichen der Hautalterung gleichzeitig zu bekämpfen.
Es kombiniert eine Reihe von wissenschaftlich nachgewiesenen Inhaltsstoffen, die synergistisch zur Verringerung der zellulären Seneszenz, zur Förderung der Autophagie und zum Schutz der Zellen vor oxidativem Stress wirken.
- Mit diesem kraftvollen Duo werden deine Zellen erneuert und revitalisiert.
- Cell Primer: Macht den Weg frei, indem es die zelluläre Autophagie und die Beseitigung von Zombiezellen in Gang setzt.
- Booster: Nährt deine Zellen, steigert die Energieproduktion und die zelluläre Widerstandskraft.
References